中国创新药破局:从分子导向到疾病导向
作者:头飞雪
数月前的First in class VS Fast follow之争,近日俨然已经偃旗息鼓,然而这并不意味着中国创新药行业对前行方向的集体迷茫就此消失,只是换做其他新热点后继续体现,譬如港股18A IPO连续破发,譬如科创板第五条给予License in的压力。
无论一级市场融资如何火爆,都无法掩盖行业当下弥漫的焦虑:从PD-1到Claudin 18.2、KRAS G12C、FGFR、CD47,甚至SHP2,新靶点研发内卷愈演愈烈,中国创新药下一步,究竟该怎么走呢?
创新药企在焦虑,背后的资本也不遑多让。Fast follow毫无疑问越走越窄,难道就此直接转型First in class?看看欧美研发成功率,马上又给吓住。进不是,退也不是,停止不前更不可能,莫非在中国做创新药真就是一局死棋?
科学研究中,当面对繁杂问题渐入绝境时,往往会尝试溯游而上,重新回归问题本源。许多时候,常识视角反而会颠覆习惯性认知,更好地看清问题和求解答案。譬如,虽然我们每天都在谈论肿瘤细胞的特异性靶点或生物标志物,然而根据Douglas Hanahan和Robert Weinberg 2011年在Cell上发表的经典综述《Hallmarks of Cancer: The Next Generation》,肿瘤细胞公认最本质的十大特征,却没有一项是单独蛋白maker。是不是感觉意料之外,却又情理之中?
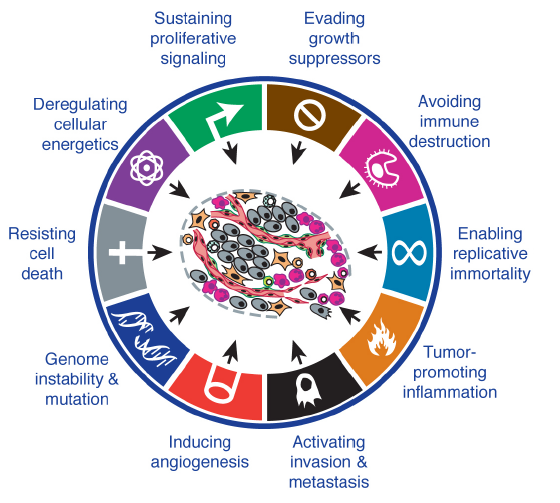
借助类似思路,我们不妨回头想想,创新药物研发的本质是什么。
疾病导向,还是分子导向?
笔者以为,当下中国创新药扎堆内卷等诸多怪相,很大程度源自于行业诸多参与者的根本动机出现了偏差:本质应该是疾病导向的药物研发,多年来在中国被异化成为了分子导向。
何谓分子导向?就是抉择研发方向的标准是能否做出针对某靶点的某种分子,准确地说风口上的某种分子。临床是否有价值不重要,患者是否获益不重要,市场是否有前景不重要,甚至能否如期获批都未必重要。唯有这类分子、这个靶点、这个技术在不在风口,或者可以预见的时间内会不会上风口才重要。
何谓疾病导向?判断研发有价值与否的标准,是能否为某种疾病的治疗提供解决方案,使患者获益。不管大分子、小分子、FIC、Fast follow、联用、老药新用等等,就看能否解决未满足临床需求,抓住老鼠的就是好猫。
显然,疾病导向的创新药研发,是患者和临床医生的诉求,甚至也是政府监管部门的诉求。君不见,FDA和NMPA分别现行的四条加速审评通道,标准描述都是疾病和临床需求的特征,从来没说哪类分子或哪个靶点应该就被加速审评。
相较而言,分子导向的创新药研发,却是当下诸多中国创新药企业,以及背后绝大多数资本的诉求。分子导向和疾病导向并不是非此即彼,这两者确实也有相当程度overlap,尤其回溯前十余年创新药的研发历程。可是,如果视角转到面向未来中长期的战略抉择,两种导向正在日益分道扬镳:需求端对疾病导向的需求正在快速增加,可供给端依旧还是分子主导。
看清这样的差异,就不难理解为何国内Fast follow内卷到如今程度。
过去十余年中,相当多的中国创新药公司介绍项目,大抵是这般情形:“我们选择这个靶点,某MNC已上市(现在会说人家在Phase II/III数据很好),我们重新设计化合物结构/筛选抗体,你看我分子的Potency/DMPK/Safety,数据显然更优,而且在国内企业大概进度第1/2/3名,我是me better”。听起来,也没多大毛病?
可再往深了问,原研为什么选这个靶点,MOA是什么,做了哪些模型,最适合哪些癌种,有哪些问题没解决,有哪些新进展,临床定位和风险是什么,如何差异化竞争,等等这些,大咖们的回答底气立刻就没刚才那么足了。毕竟原研可能做40个PDX模型,we-better们不知道有没有做足4个CDX。
当然,多数投资人没有这么专业,钱也就拿到了,分子也就推了,然后上临床了,然后和一大波临床医生无法分辨的me better开始抢病人。如今机会更好,或许药还没上市,公司倒先咬着牙也上市,然后开始破发。
类似的故事从小分子讲到大分子,讲到C-ART,未来不排除还会讲到ADC、各种RNA、基因治疗,林林总总。诚所谓秦人不暇自哀,而后人哀之 ,后人哀之而不鉴之,亦使后人而复哀后人也。
疾病是目的,分子是手段
分子导向的创新药研发模式显然越走越窄,唯有转型疾病导向,方是未来出路。
事实上,在欧美成熟的产业格局中,绝大多数时候,评判生物技术公司价值几何,一定是从需求端,而非药物类型。典型例子莫过于去年伊始,mRNA赛道一飞冲天。是因为mRNA药物技术瞬间重大突破吗?非也,更多还是疫情爆发叠加欧美传统类型疫苗产业薄弱,使mRNA疫苗几乎成为最受期待的解决方案,背后逻辑仍是疾病需求导向。
至于在中国,mRNA赛道爆发的逻辑则基本是“你看Moderna的估值和mRNA疫苗在欧美的热度,我能做出这样的东西”,这依然是分子导向。
分子导向简单易上手,尤其是在中国已具备完善医药工业体系的今天,但问题是天花板有限:欧美工业蹚出的成熟路径就那么多,谁都能上。
疾病导向以未满足临床需求为目标,是真正的星辰大海,空间广阔,只是没有成熟路径,要逢山开路,遇水架桥,真正找出创新的解决方案。在此过程中可能有新分子实体出现,也可能没有。因为分子只是手段,解决疾病才是目的。
疾病导向的创新转型:致病机制、患者特征和药物机理
疾病导向的研发创新转型自然是艰辛的。中国创新药近年来虽已在加速追赶欧美,但整体仍有落差。加之医疗基础、支付环境等诸多差异,等全盘照搬欧美模式到中国是不现实的。尽管如此,并不妨碍在我们某些策略上借鉴欧美企业的成熟做法,从中寻找创新机会。具体而言,不妨考虑从加强对致病机制、患者特征和药物机理三方面的研究开始。

加强致病机制研究
针对疾病致病的分子机制,基于最新涌现基础研究成果,通过转化医学研究策略,为未满足临床需求寻找和验证全新解决方案。
我们正处于当下生物学基础研究爆炸的时代,新机制发现和技术手段层出不穷。不过这些源自于学术界基础研究成果,相对未解决临床需求尚有一定距离,这些都需要工业界通过转化医学研究进一步验证和优化,包括但不限于:
对文献发表结论的可靠性进行重复验证和确认;
通过更接近疾病状态以及被临床认可的模型(诸如病人样本、PDX、大动物等)验证;
结合临床意见,对目标适应症(诸如癌种、阶段等)或敏感人群更细致探索;
对候选分子进行成药性、剂量、开发路线等多方面优化
对联用、序贯等常用的临床治疗方案进行更广泛探索。
通过这些,工业界能够基于学术界最新发现前进一步,增加对致病机制认知和数据积累,在此基础上寻找创更新的解决方案。循此路径开展的后期临床研究,也将是有的放矢,风险可控程度和临床成功率都能显著提升。
靶向PCSK9药物研发可作为经典案例。学术界发现家族性高胆固醇血症PCSK9 gain of function以及LDL胆固醇浓度、冠心病低发病率人群PCSK9 loss of function现象,随后进行PCSK 9功能临床前动物模型验证,工业界由此开发进一步开发单抗候选药物,推向临床,并在2015年获批上市。
国内的情形是,相对基础科研和临床研究而言,转化医学研究可能多年来是进步最慢的短板。好在近两年,学术界和工业界也加速发力,创新成果开始涌现。
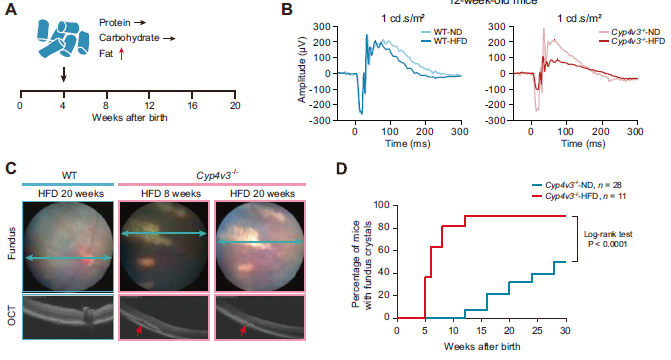
学术界方面,基础科研和临床研究合作正在不断加深。2020年报道,协和医院眼科睢瑞芳团队与中国科学院动物所李伟团队合作,在全球首度通过高脂饮食诱导成功构建结晶样视网膜变性(Bietti crystalline dystrophy, BCD)小鼠模型并进行基因治疗验证。据了解,基于相关成果的基因治疗药物开发也已在公司主体中开始推进。
工业界对致病机制的转化医学研究重视程度也在加深。由先后任职MSD中国临床研究副总裁及Roche上海创新中心主管的王在琪博士创立的应世生物,以肿瘤耐药的创新治疗为方向,诸多管线布局和开发策略均是基于最新学术发现,并开展诸多内部自主和外部合作的转化医学研究探索,积累了对目标癌种耐药生物学机制的独特理解,由此确立真正自主创新的治疗策略。据公司8月公告,旗下FAK抑制剂治疗铂耐药卵巢癌,基于前期优异的临床数据,已获FDA快速通道认定,未来或有望成为中国转化医学创新药开发的标志性案例。
此外,国内某些开发自体免疫病新靶点的创新药公司,也开始在临床前研究过程中就积极尝试与临床医生合作,基于患者组织样本,寻找某些目标靶点高表达、且与国外临床不同的自体免疫疾病适应症,进行进一步验证和探索开发,这都是很好的开始。
加强对患者特征研究
相较20年前甚至10年前,如今大量新兴的生物学分析手段,诸如基因组突变、蛋白质组、转录组甚至更新的单细胞组学、表观遗传等诸多特征,以及相应的大数据分析手段,使我们拥有能够获取超过既往单纯生化、影像、病例之外的更多患者信息数据。这些我们能够对患者进行更精准的分析和区别定位,寻找当前在研/上市药物中最合适的方案,真正做到“对症下药”。
这样的路径已为工业界带来不少成功先例。譬如通过探寻黑色素瘤患者和结直肠癌患者使用BRAF-V600E抑制剂预后的显著差异,研究人员发现结直肠癌患者的肿瘤细胞暴露于BRAF抑制剂时,EGFR信号通路被异常激活,由此判断这可能是结直肠癌患者对BRAF-V600E抑制剂不敏感的重要原因,并由此催生了诸多BRAF/EGFR抑制剂组合(或增加MEK抑制剂)联合用药的临床试验。在这其中, BRAFTOVI三联体组合(BRAFTOVI + MEKTOVI +西妥昔单抗)方案临床效果显著,与对照组相比死亡率降低了48%,并最终催生了Pfizer 114亿美元收购Array的大手笔交易。
中国的某些创新药项目,也开始逐渐在临床方案设计中,加强对患者特征研究,尝试从类似靶点和分子设计的药物中获得差异化的定位和优势证据,譬如沈琳教授近期在会议上报道荣昌生物抗RC-48(HER2 ADC)的胃癌PhaseI研究。该研究将所有HER2免疫组化阳性(包括1+、2+、3+不同强度,FISH阳性和阴性)病人均有入组,并进一步证实HER2 2+、FISH阴性的病人获益跟HER23+病人完全类似。基于此结果,RC-48目标患者人群增加了将近40%,并简化了检测流程,使筛查的可行性明显增加。
类似策略的还有8月份港股18A交表的南京药捷安康。其聆讯资料显示,公司将其重磅产品TT-00420与基因组分析平台Foundation Medicine签订协议。Foundation将为该项目提供高级基因组分子、数据库查询、临床基因组注册及其他活动。
尤其值得欣慰的是,一批本土新兴的小型生物技术公司,在诸多前沿分析和研究领域,包括单细胞测序(百奥智汇、新格元)、蛋白质组(景杰)、磷酸化组学(嘉华药锐)、冷冻电镜(水木清华)、转基因小鼠(百奥赛图、集萃药康、南模)、PDX(立迪、艾德摩)、类器官(科途)、生物标志物(迈杰)等,也包括医药魔方这样的行业数据平台,均开始不断为中国创新药研发企业和临床&转化医学研究机构提供更多丰富且高效的技术解决方案,使得国内针对患者特征研究不必再单纯依赖于国外企业。这些研究活动均有望在未来进一步夯实中国创新药研究的土壤。
加强药物机理研究
除针对致病机制和患者特征外,对药物机理特质的深入研究,亦可以拓展对现有药物全新的适应症和应用场景,同样可能成为创新的源泉,譬如既往熟知的沙利度胺、西地那非、阿司匹林等经典药物的适应症拓展。
近年来,基于对已获批药物机理的深入研究,包括肿瘤药物Rituximab治疗关节炎、 骨质疏松药物Raloxifene治疗乳腺癌等诸多尝试,均是不断拓展药物创新的思路。这个方向是一个庞大的话题,篇幅有限,在此不再详细展开,感兴趣的朋友推荐阅读Nature Review Drug Discovery 2018 年的一篇综述文章Drug repurposing: progress, challenges and recommendations。
正本清源:中国创新药的导向回归
十余年来,分子导向主导了中国的创新药研发,这也是为何诸多创始人的履历里,药化、大分子QA/QC等背景占了多数。应该说这也是时代的需求,毕竟此前中国医药工业体系和欧美相去甚远,不要说复刻,纵能山寨MNC的Blockbuster,也是在造福国内患者。
时至今日,中国医药产业体系已然充分接轨国际。仅本土CRO货架上,各种成熟靶点的分子琳琅满目,做个新分子比十几年前做仿制药都容易。如此这般,此前的“创新”模式势必不再能持续。少数意识和能力领先中国创新药企业,开始迈向真正疾病导向的创新药研发,虽然还很有限,但当是未来必须的方向。
疾病导向的药物研发,将为创新打开广阔的空间。传统认知的FIC,所谓新靶点+新分子,确是疾病导向创新药研发的一部分,但并非全部。一方面,全新的适应症定位、患者群体拓展、联合治疗、用药策略、伴随诊断等等这些,同样也是创新的重要组成。另一方面,新靶点+新分子只是创新的表象。真正夯实创新的基础,在于深入其中,从致病机制、患者特征、药物机理等诸多方面,开展基础和转化医学研究,积累扎实而深入的全新认知,为后续创新药开发保驾护航。
唯有如此,我们的创新药研发,才能既避开跟风扎堆的Fast follow模式,又避开过往某些China Only特色的FIC,真正做到稳步前行,对接未满足临床需求,使患者获益,并最终获得国际水准的创新认可。
参考资料
[1]Hanahan D, Weinberg RA. Hallmarks of cancer: the next generation. Cell. 2011 Mar 4;144(5):646-74.
[2]Qu B, Wu S, Jiao G, et al. Treating Bietti crystalline dystrophy in a high-fat diet-exacerbated murinemodel using gene therapy. Gene Ther. 2020 Aug;27(7-8):370-382.
[3]Prahallad A, Sun C, Huang S, et al. Unresponsiveness of colon cancer to BRAF(V600E) inhibition throughfeedback activation of EGFR. Nature. 2012 Jan 26;483(7387):100-3.
[4]Pushpakom S, Iorio F,Eyers PA, et al. Drug repurposing: progress, challenges and recommendations. Nat Rev Drug Discov. 2019 Jan;18(1):41-58.
上一篇:JAMA子刊:近50种免疫介导疾病都与癌症风险相关 有哪些特征?
栏 目:医疗创新
下一篇:Alphabet成立致力于AI药物研发的Isomorphic子公司
本文标题:中国创新药破局:从分子导向到疾病导向
本文地址:
您可能感兴趣的文章
- 05-31无烟日前夕 英国控烟专家《柳叶刀》发文力挺将电子烟纳入医疗处方
- 04-13RNA疗法离我们有多远?
- 09-16安联世合将Digital Health Assistant拓展至亚太区十个市场
- 12-24JAMA子刊:近50种免疫介导疾病都与癌症风险相关 有哪些特征?
- 11-05Alphabet成立致力于AI药物研发的Isomorphic子公司
- 04-13500年历史的手术机器人 是改变未来十年的希望吗?
- 04-11AI驱动疾病发现和护理协调 1亿美元助力改善医疗系统工作效率
- 04-12从应急医疗中心看高成本医疗服务的替代悖论
- 11-28抗生素安全领域取得突破:传感器和人体组织相结合,打造仿生技术智能“肾脏芯片”
- 03-25后疫情时代 互联网医疗发展模式及特点浅析
阅读排行
推荐教程
- 10-30奥泰医疗并入先导科技集团,打造高端医疗影像全产业链
- 10-30药明康德2023年前三季度业绩稳健增长
- 09-18新型药物可阻止器官移植中的关键衰老机制
- 09-11迪哲医药全球首款T细胞淋巴瘤JAK1抑制剂戈利昔替尼研究成果刊于《肿瘤学年鉴》,影响因子高达51.8
- 09-11阿斯利康在2023欧洲呼吸学会(ERS)的临床研究数据表明,其在呼吸系统疾病治疗转型为吸入剂和生物制剂综合治疗的过程中处于领导性地位
- 09-11宁科生物实控人被立案,屡次转型却连年亏损…
- 09-06医疗康复:脑机接口产业化第一站
- 07-05一种水螅为衰老和再生提供新见解
- 07-05运动数据有助提早发现帕金森病
- 07-05一种水凝胶可再生子宫内膜,有望治疗不孕不育症






