AZ/第一三共Enhertu虽迟但到 国内HER2 ADC领域混战将至
3月21日,CDE官网显示,阿斯利康/第一三共的ADC药物Enhertu在国内申报上市,这意味着HER2 ADC领域的BIC药物即将登陆国内市场,尽管适应症仍然未知,但笔者猜测大概率是HER2阳性转移性乳腺癌。这点从恩美曲妥珠单抗近期的大幅降价可见一斑。
01 Enhertu简介
Enhertu(DS-8201)由阿斯利康和第一三共联合研发,将人源HER2抗体曲妥珠单抗通过四肽接头与一种新型拓扑异构酶Ⅰ抑制剂链接,靶向癌细胞,并将药物递送至细胞内部。Enhertu可谓引领了新一代ADC药物的发展热潮,DNA拓扑异构酶抑制剂DXd、高DAR、可剪切Linker的设计颠覆了ADC药物领域。2021年,Enhertu实现4.26亿美元的收入,同比增长123%。
(1)DXd:Enhertu使用的细胞毒药物为一种创新DNA拓扑异构酶(Topo)Ⅰ抑制剂(DXd),活性是伊立替康(SN-38)的10倍,可干扰DNA复制、重组和基因表达。与微管蛋白抑制剂相比,DNA抑制剂具有诸多优势:一方面,细胞内微管蛋白抑制剂的靶标数量远超DNA抑制剂的靶标数量,在ADC携带相同数量弹头进入细胞的情况下,DNA抑制剂能发挥更好的杀伤作用;另一方面,微管蛋白抑制剂半衰期较长,DNA抑制剂半衰期短,不易在体内发生蓄积。
(2)DAR:Enhertu的DAR为8,每一个抗体分子上能够偶联8个化疗药物。通过高DAR搭配中等毒性Payload的组合,不但可以更好地发挥抗肿瘤作用,而且脱靶毒性有望降低。
(3)可剪切Linker:Enhertu的连接子在血液中表现出良好的稳定性,在肿瘤细胞内可被组织蛋白酶特异性切割。可剪切Linker(Cleavable Linker)一方面可在靶细胞中被切割,释放出小分子毒素,对靶细胞发挥杀伤作用;另一方面小分子毒素可透过细胞膜,进入附近低表达的肿瘤细胞中,发挥旁观者效应(bystander effect)。
图:Enhertu细胞毒药物和Linker特点
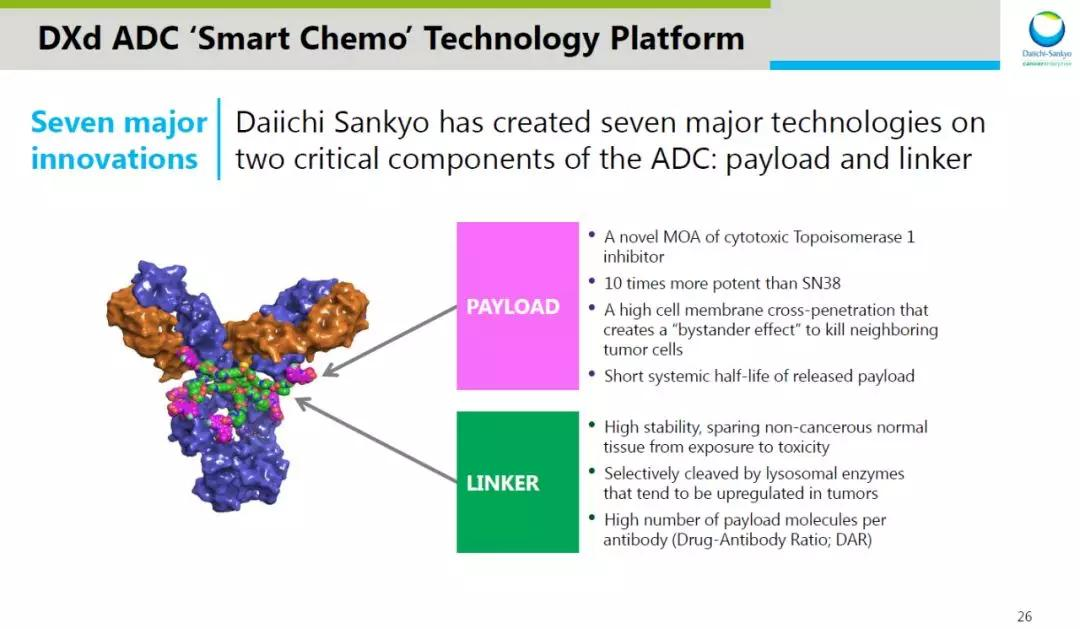
数据来源:第一三共
FDA批准:Enhertu于2019年12月20日获FDA批准上市,适应症为治疗HER2阳性转移性乳腺癌。试验表明,Enhertu治疗乳腺癌的ORR达60.9%,CR达6%,PR达54.9%,DoR达14.8个月,mPFS达16.4个月。安全性方面,除了常见的中性粒细胞计数下降外,间质性肺炎值得关注。
2021年1月15日,Enhertu晚期或转移性HER2阳性胃或胃食管交界(GEJ)腺癌适应症获FDA批准,成为首个被批准治疗HER2阳性胃癌的抗体偶联药物。试验数据表明, Enhertu治疗组 VS 化疗组的OS为12.5个月 VS 8.4个月;mPFS为5.6个月 VS 3.5个月;ORR为40.5% VS 11.3%,CR为7.9% VS 0%,PR为32.5% VS 11.3%;mDOR为11.3个月 VS 3.9个月。另一款HER2 ADC药物Kadcyla(T-DM1)对晚期胃癌已宣布无效,原因可能在于DM1对于结直肠及大部分胃肠道肿瘤活性较低,不适用于不敏感肿瘤的治疗。
02 国内获批的HER2 ADC一览
目前,国内已有两款HER2 ADC药物获批上市,分别是罗氏的恩美曲妥珠单抗和荣昌生物的纬迪西妥单抗。此外,浙江医药、科伦药业、嘉和生物等亦深耕于此,HER2 ADC的竞争一触即发。
(1)Kadcyla(恩美曲妥珠单抗,T-DM1)是一款HER2 ADC药物,于2013年获FDA批准上市,先后获批HER2阳性转移性乳腺癌和接受新辅助治疗后残存病灶的HER2阳性早期乳腺癌的辅助治疗。2020年1月,T-DM1获NMPA批准上市,适应症为接受紫杉烷类联合曲妥珠单抗为基础的新辅助治疗后,仍残存侵袭性病灶的、HER2阳性早期乳腺癌患者的辅助治疗。
结构设计上,T-DM1采用曲妥珠单抗,细胞毒药物采用了微管蛋白抑制剂DM1,连接子采用MCC Linker。T-DM1作为早期的ADC药物,其结构设计存在不足,在payload的选择上,DM1毒性有限,不及同为微管蛋白抑制剂的MMAE和MMAF,纵观上市的ADC药物,仅T-DM1采取了DM1作为Payload;此外,由于采用不可裂解的linker,尽管稳定性提升,但不具有旁观者效应。
上市以来,凭借乳腺癌广泛的患者群体和独特的治疗机制,T-DM1全球销售额持续攀升,2021年全球销售额达21.78亿美元,同比增长16%,依然是ADC领域的佼佼者。但在国内市场,T-DM1的销售额难言乐观,根据wind医药库,T-DM1在2020年样本医院销售额仅1665万元。售价较高是Kadcyla销售额不佳的主要原因,但罗氏正积极调整销售策略。2022年3月,Kadcyla在国内主动降价,降幅超50%,160mg/瓶由27632元降至13184元,100mg/瓶由19282元降至9200元,降幅之大令人咋舌,但考虑DS-8201上市的冲击,公司的市场策略可谓明智。
图:T-DM1结构
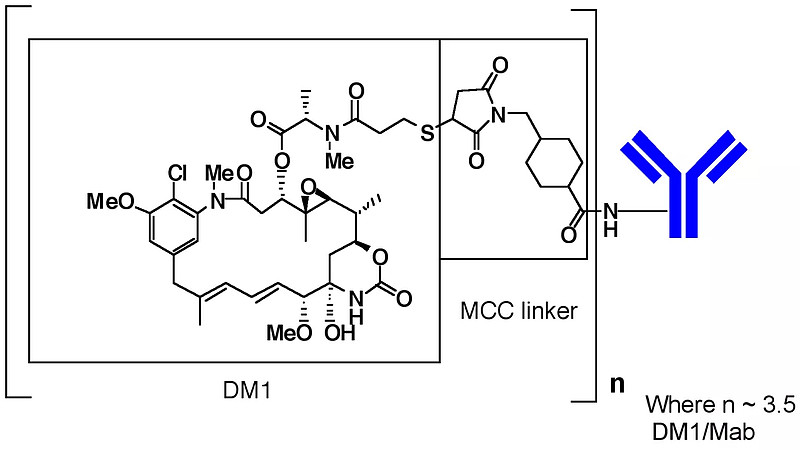
数据来源:罗氏
(2)维迪西妥单抗(RC48)为荣昌生物自主研发的HER2 ADC药物,商品名为爱地希。2021年6月,维迪西妥单抗获NMPA批准上市,用于治疗至少接受过2种系统化疗的HER2过表达局部晚期或转移性胃癌患者。无独有偶,2022年1月5日,维迪西妥单抗获批尿路上皮癌适应症。
维迪西妥单抗结构包括三部分:
(1)Disitamab是一种靶向HER2的单克隆抗体。与曲妥珠单抗20.1的EC50相比,Disitamab的EC50仅6.4pM,这意味着Disitamab与HER2的亲和力更高,达标剂量有望降低,副作用可能更小。
(2)Linker采用半胱氨酸偶联,均一性较赖氨酸大幅提升。采用可裂解的linker,具有旁观者效应,可更好地发挥旁杀伤作用。
(3)Payload为微管蛋白抑制剂MMAE,可阻断微管蛋白聚合,与DM1相比,MMAE具有更高的膜通透性,理论上具有更强的毒性。
图:维迪西妥单抗结构
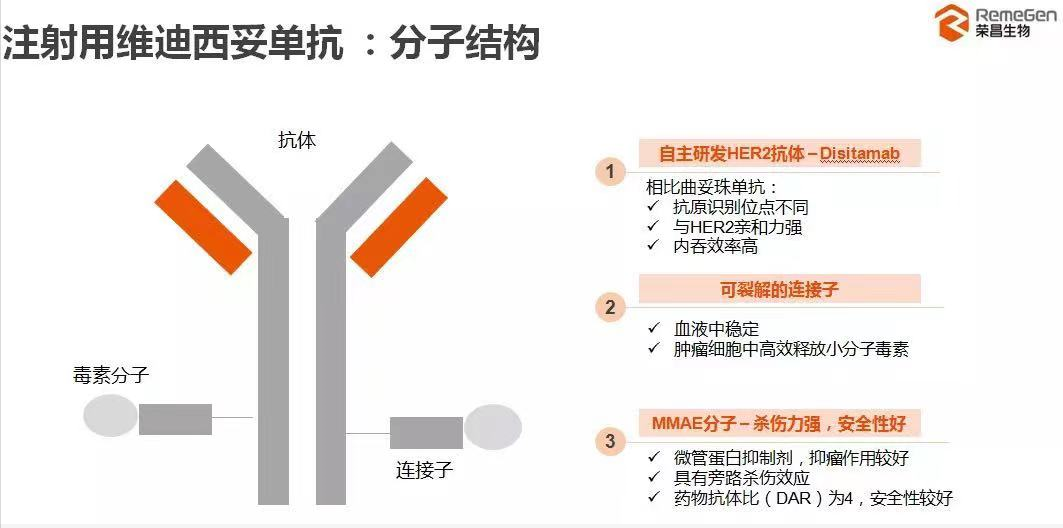
数据来源:荣昌生物
03 HER2 ADC竞争愈演愈烈 谁能脱颖而出
受全球创新浪潮的冲击和ADC药物的更新迭代,HER2 ADC药物的研发热情高涨,一大批生物医药企业相继奔赴HER2 ADC药物创新的战场。目前,我国已经有两款HER2 ADC药物获批上市,DS-8201递交了上市申请,此外,浙江医药、科伦药业、乐普生物等二十余家企业深耕于HER2 ADC,这一赛道的竞争可谓愈演愈烈。而当产品扎堆后,价格战似乎在所难免,近期T-DM1主动降价52%,足以窥见这一赛道未来的残酷性。
因此,对于制药企业而言,与时间赛跑,提升研发速度,享受先发优势可谓关键。在美国市场,尽管T-DM1临床数据远不及DS-8201,但凭借先发优势牢牢占据了乳腺癌市场份额,2021年DS-8201仅实现了4.26亿美元的销售额,而T-DM1凭借21.78亿美元的销售额依旧傲视群雄。除了研发速度外,避免适应症扎堆亦是企业需要思考的重点,荣昌生物的维迪西妥单抗避开了乳腺癌这一热门靶点,优先布局了胃癌和尿路上皮癌,充分凸显了公司决策的智慧。
上一篇:百奥赛图与乐普创一达成基于类TCR抗体的多特异性抗体药物开发合作
栏 目:新药研发
下一篇:细菌对抗生素耐药?创新方法或能解决这一世界性难题 |《自然》技术特写
本文标题:AZ/第一三共Enhertu虽迟但到 国内HER2 ADC领域混战将至
本文地址:
您可能感兴趣的文章
- 04-06浅谈:QbD在药物开发中的应用
- 03-22凯复宣布KF-0210 临床I期完成首例患者给药,获1亿元人民币A+轮投资
- 09-06诺诚健华宣布奥布替尼治疗复发/难治性边缘区淋巴瘤纳入优先审评
- 05-18超13亿美元!渤健携手Capsigen合作开发基因疗法
- 03-31基石药业宣布潜在全球同类最佳药物CS5001(ROR1 ADC)I期临床在美国完成首例患者入组
- 03-24百奥赛图与乐普创一达成基于类TCR抗体的多特异性抗体药物开发合作
- 07-09治疗R/R FL!正大天晴PI3Kα/δ双抑制剂拟纳入突破性疗法
- 04-12阿斯利康推出下一代PARP抑制剂 有望延续Lynparza的成功
- 04-1150+抗PD药物获批上市 多企业联手布局掘金创新疗法
- 12-20BridGene达成合作 创新表型筛选针对乳腺癌难成药靶标
阅读排行
推荐教程
- 10-30奥泰医疗并入先导科技集团,打造高端医疗影像全产业链
- 10-30药明康德2023年前三季度业绩稳健增长
- 09-18新型药物可阻止器官移植中的关键衰老机制
- 09-11迪哲医药全球首款T细胞淋巴瘤JAK1抑制剂戈利昔替尼研究成果刊于《肿瘤学年鉴》,影响因子高达51.8
- 09-11阿斯利康在2023欧洲呼吸学会(ERS)的临床研究数据表明,其在呼吸系统疾病治疗转型为吸入剂和生物制剂综合治疗的过程中处于领导性地位
- 09-11宁科生物实控人被立案,屡次转型却连年亏损…
- 09-06医疗康复:脑机接口产业化第一站
- 07-05一种水螅为衰老和再生提供新见解
- 07-05运动数据有助提早发现帕金森病
- 07-05一种水凝胶可再生子宫内膜,有望治疗不孕不育症






